Calcul de la densité spécifique/masse volumique d'une monnaie
Reading time 2 min
Bonjour à tous,
Suite à l'article relatif à mon denier de Neron qui s'est révélé fourré (voir là : https://www.colleconline.com/fr/users/258/potator-ii/blog/131/ce-pauvre-neron-a-fini-dans-les-fourres), on m'a demandé de faire le point sur la façon de déterminer la masse volumique d'une monnaie (ou sa densité spécifique).
Définitions :
- La masse volumique d'un solide est le rapport de la masse par son volume, l'unité utilisée est le Kg/m3
- La densité d'une matière est le rapport de la masse volumique de cette matière sur la masse volumique de l'eau. Elle s'exprime sans unités car c'est un rapport et pas une mesure
De manière plus simple, il s'agit d'appliquer le principe d'Archimède : tout corps immergé dans l’eau déplace son volume en eau. Comme la densité de l'eau est de 1 (1 ml d'eau distillée = 1 gr d'eau distillée) si on peut mesurer l'un, on connaît automatiquement l'autre.

Comme dit l'autre, c'est simplissime....allez je vous montre
Il vous faut :
- Une balance de précision au 1/100 de gramme
- Un récipient qui tienne sur le plateau de la balance
- De l'eau distillée
- De quoi suspendre une monnaie sans modifier sensiblement le volume qui trempera dans l'eau (fil a broder par exemple)
- Une calculatrice
Nous allons donc peser une monnaie, ici un beau denier de l'Empereur Domitien (nous aurons ainsi sa masse), puis mesurer son volume ce qui nous donnera sa masse volumique (trop fastoche....)

1 - Allumez votre balance de précision, vérifiez que la tare est bien sur zéro, et que l'unité est bien le gramme, puis pesez la monnaie :

2 - Remplissez maintenant le récipient avec de l'eau distillée. Il doit être assez grand pour que la monnaie, une fois immergée complètement, ne touche ni le fond ni les bords. De plus, le récipient plein d'eau ne doit pas dépasser le maximum de pesée de votre balance. Enfin, ajustez la tare de la balance pour qu'elle soit sur zéro avec le récipient plein d'eau posé sur le plateau :
 |
 |
3 - Partie la plus délicate : vous allez devoir accrocher la monnaie à un fil le plus fin possible sans faire un trou dedans à la chignole, et si possible sans prendre de Lexomil©. Une fois cette opération réussie (vous avez droit à 25 tentatives :) ), vous tremperez la monnaie dans le récipient en la tenant par l'extrémité du fil. La balance vous indiquera alors la masse d'eau déplacée, qui, comme nous l'avons vu plus haut est équivalente au volume d'eau déplacé, donc au volume de la monnaie (nous négligerons le volume du fil lui même)

Et voilà, le tour est joué : vous divisez maintenant la masse par le volume et obtenez la masse volumique (ou la densité)
3,22 / 0,32 = 10,06
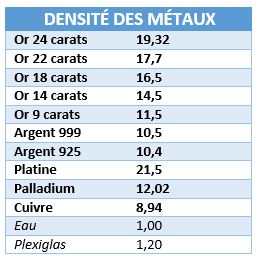
Il ne vous reste plus qu'à comparer votre résultat avec un tableau de densité des différents métaux précieux tableau 1 montrant la densité de l'argent en fonction de son degré d'alliage, tableau 2 montrant la densité de métaux et matériaux divers:
 © Antoine
© Antoine
Et enfin, avec mes remerciements à Antoine, voici un graphique illustrant la teneur en argent des monnaies au cours de l'Empire romain :

Merci de m'avoir lu jusqu'au bout
Pot'
